Micorrizas Autóctonas como Indicadores de Salud y Calidad del Suelo
Chacón, Ana1 Universidad Politécnica Territorial de Maracaibo (UPTMA) anamariachaconguerrero@gmail.com
González, Marisela2 Universidad Politécnica Territorial de Maracaibo (UPTMA) marigonli@gmail.com Recibido: 17/03/2024 Aceptado: 03/04/2024
RESUMEN
La calidad y salud de los suelos es la base para la obtención de productos agrícolas saludables y de alta productividad que permiten una buena alimentación de los individuos y en consecuencia calidad de vida de la población Razón por la cual se realiza la investigación en los suelos del fundo Santa Elena, ubicado en la parroquia Raúl Cuenca Municipio Valmore Rodríguez, Estado Zulia, con el objetivo de evaluar las condiciones fitosanitarias, salud y calidad de los suelos del mencionado fundo, mediante la determinación de insectos plagas y enfermedades en los diferentes cultivos que se estaban desarrollando en el mismo. La salud y evaluación de los suelos se realizó mediante la determinación del PH y de la presencia de microorganismos beneficiosos relacionados con los hongos micorrizicos responsables de la absorción de vitaminas, minerales y agua para favorecer la salud y rendimiento productivo en los diferentes cultivos. La investigación fue experimental de campo y laboratorio: se realizó una visita a la unidad de producción en la cual se recolectaron 90 muestras de suelo, 10 de raicillas y 10 de follaje, los cuales fueron procesadas en el laboratorio obteniendo los siguientes resultados: Análisis microbiológico a través de las micorrizas, el género más predominante fue el Glomus spp, con porcentajes de micorrizacion en raicillas de bajo a mediano representado por micelio interno, externo y vesículas. En cuanto al análisis fitosanitario se observó la presencia de Fusarium spp, y ácaros, y fitopatógenos, en cuanto al pH del suelo se consiguieron valores entre 4.20 a 8.34.
Palabras clave: Salud del suelo; Micorriza; Alimentos inocuos.
ABSTRACT
The quality and health of the soil is the basis for obtaining healthy and highly productive agricultural products that allow good nutrition for individuals and, consequently, quality of life for the population. Reason why research is carried out on the soils of the Santa Elena farm, located in the Raúl Cuenca parish, Valmore Rodríguez Municipality, Zulia State, with the objective of evaluating the phytosanitary conditions, health and quality of the soils of the aforementioned farm, by determining insect pests and diseases in the different crops grown. we’re developing in the same. The health and evaluation of the soils was carried out by determining the PH and the presence of beneficial microorganisms related to mycorrhizal fungi responsible for the absorption of vitamins, minerals and water to promote health and productive performance in different crops. The research was experimental in the field and laboratory: a visit was made to the production unit in which 90 soil samples, 10 of rootlets and 10 of foliage, were collected, which were processed in the laboratory obtaining the following results: Microbiological analysis through mycorrhizae, the most predominant genus was Glomus spp, with low to medium mycorrhization percentages in rootlets represented by internal and external mycelium and vesicles. Regarding the phytosanitary analysis, the presence of Fusarium spp, and mites, and phytopathogens was observed egarding the pH of the soil, values between 4.20 to 8.34 were achieved.
Keywords: Soil Health; Mycorrhiza; Safe food.
Introducción
La calidad y salud de los suelos es la base para la obtención de productos agrícolas saludables de alta productividad que permiten una buena alimentación de los individuos en el planeta, la obtención de alimentos saludables libres de residuos tóxicos, lo cual permite al consumidor mantener una buena salud lo que repercute en mejor calidad de vida de la población.
Por lo tanto, la erosión del suelo constituye el principal proceso de degradación de las tierras. Este proceso ha sido estudiado ampliamente, más no su efecto sobre la productividad. Muchos de los suelos con vocación agrícola y ganadera en Venezuela, sufren problemas de erosión que limitan seriamente su capacidad productiva. De ahí que la cuantificación de las pérdidas de suelo ha representado un problema de difícil solución debido a la escasa información existente en áreas inaccesibles y el desconocimiento de los productores, acerca de la problemática. Los distintos grados de erosión que se presentan en el país, debido a los factores geológicos y principalmente antrópicos, son una realidad preocupante que nos lleva a reflexionar sobre el uso y conservación de nuestros recursos naturales (Urdaneta, 2011).
En la mayoría de los ambientes agrícolas, se ha llegado a la percepción que la agricultura moderna enfrenta una crisis ambiental, debido al empleo de prácticas intensivas, con utilización de elevadas cantidades de insumos químicos, unidos a tecnologías que conllevan a la degradación de los recursos naturales, como son los procesos de erosión, salinización, contaminación por pesticidas, desertificación, y perdida de la fitomasa, factores que en su conjunto, provocan una reducción progresiva de la productividad (Altieri, 1994).
El desarrollo de prácticas conservacionistas enfocadas en el esquema de sostenibilidad genera cambios en la calidad del suelo. El conocimiento de su actividad permite el uso más racional de los suelos y la propuesta de prácticas de manejos agroecológicos que ayuden su mantenimiento. (Rodríguez et al., 2011)
Los microorganismos constituyen un factor importante en el proceso de formación de los suelos; participan en la transformación de los compuestos orgánicos y minerales, e influyen en el contenido y movilidad de los macro y micro elementos en su balance y asimilación por las plantas. Por lo tanto, para obtener una agricultura sustentable y sostenible se debe considerar la actividad biológica de los suelos. El crecimiento y el rendimiento de las plantas dependen de varios factores como son: la disponibilidad del agua, nutrientes del suelo, microorganismos beneficiosos y su medio de desarrollo, así como también, el control de factores ambientales: temperatura, luz y humedad. También se considerará la protección que tengan contra el ataque de insectos plagas y enfermedades, porque todo lo que afecta la salud de las plantas influye en su crecimiento y producción disminuyendo de manera notable su utilidad para la naturaleza y para la humanidad.
Las causas más comunes del crecimiento deficiente de las plantas y de destrucción de cosechas son los fitopatógenos, clima desfavorable, malezas e insectos plagas. Las enfermedades fitopatogenas, sus causas, etapas de desarrollo son iguale y complejas como las desarrolladas en los animales y el ser humano.
Para determinar la calidad del suelo, uno de los indicadores biológicos más eficientes se encuentran los hongos micorrízicos arbusculares (HMA), los cuales se establecen en simbiosis con el sistema radical, y favorecen un mejor intercambio de solutos y agua entre el suelo y la planta. Por lo tanto, su determinación, refiere la salud biológica del suelo.
Para trazar estrategias encaminadas a recuperar zonas degradadas y desarrollar biofertilizantes, es importante conocer la población y diversidad de HMA nativas que existen en los suelos. Dado que es poco el conocimiento que existe acerca de la presencia de estos hongos en suelos agrícolas en el país, es necesario desarrollar investigaciones dirigidas a determinar y clasificar estos microorganismos, así como establecer sus relaciones con los factores físico químico del suelo, su simbiosis con la vegetación existente, como acción inicial, para desarrollar tecnologías dirigidas a mejorar la composición y concentración de los microorganismos.
Es por ello que se realiza esta investigación en el fundo Santa Elena, ubicado en la parroquia Raúl Cuenca del Municipio Valmore Rodríguez, Estado Zulia, se planteó como objetivo general Diagnosticarla situación fitosanitaria de los cultivos en producción en el Fundo Santa Elena a través de la salud y calidad de los suelos tomando como referencia la presencia de Micorrizas autóctonas, para el desarrollo de este objetivo se realizaron los siguientes objetivos específicos:
- Evaluar la presencia de hongos micorrizicos nativos en el fundo.
- Determinar la simbiosis de los hongos micorrizicos en las raicillas de los cultivos existente.
- Identificar los hongos fitopatógenos e insectos plagas existentes en los cultivos.
Materiales y Métodos
Procedimiento experimental
Toma de muestras: Se tomaron muestras de suelo de 10 lotes en forma de zig zag obteniéndose 9 submuestras por lote del 10 % de la superficie total de las áreas en estudio y se agruparon en subgrupos de 3. (León, 2006), Figura. 1
Figura 1: toma de muestras en forma de zizag
Fuente León (2006)
El procedimiento para la toma de muestras consistió en dividir el terreno por lotes de cada cultivo. Se tomaron muestras a una profundidad de 0 a 20 cm cada una para obtener tres muestras compuestas de un kilo aproximadamente obteniéndose un total de 90 muestras, para la evaluación de esporas de hongos micorrizicos autóctonos y medición pH. Para los análisis fitosanitarios se tomaron muestras de follaje en los cultivos para evaluar los síntomas de ataques causados por hongos e insectos fitopatógenos.
Asimismo, en las parcelas en estudio para tinción de raíces, y determinación de fitopatógenos que representan 10 lotes muestreados, se tomaron muestras de raíces aproximadamente 500 gramos por lotes, muestra de 50 gramos de raicillas de los cultivos existentes (plátano Musa paradisiaca, topocho Musa paradisiaca, yuca Manihot esculenta, caña de azúcar pasto bermuda Cynodon dacttilon, lechosa Carica papaya, maíz Zea mays, patilla Citrullus lanatus, guines Panicum maximun, Melón Cucumis melon).
Fase de Laboratorio
Extracción de esporas: Para el aislamiento y conteo de esporas de HMA se utilizó el método de tamizado (tamices de 500 μm, 355 μm y 45 μm) y decantación en húmedo con centrifugación, similar a la metodología propuesta por Gerderman y Nicholson (1963):
- Se pesó 100 g de suelo y se colocó en un vaso de precipitado, al que se le añadió 1 lt. de agua y se agitó de 3 a 5 minutos, dependiendo del tipo de suelo. Con la agitación se produjo la disgregación de los terrones.
- La suspensión se dejó reposar durante 2 minutos y se pasó a través de tamices con apertura de mallas de 500 μm, 355 μm, y 45 μm para separar las esporas de acuerdo a su tamaño.
- La agitación y decantación se repitió tres veces.
El material que quedó atrapado en los diferentes tamices se recogió con cuidado y se vertió en vasos de precipitado de 100 ml en los cuales se le agrego d40 a 50 ml de agua destilada.
- En tubos de centrifuga de 15 ml se colocó el material y luego se introdujo en el fondo una solución de sacarosa al 70%con una jeringa para formar un gradiente.
- Se equilibraron y sellaron los tubos con parafilm y colocaron en la centrífuga durante 3 minutos a 3500 r.p.m.
- Una vez cumplido el tiempo de centrifugación, los tubos se sacaron cuidadosamente de la centrifuga, teniendo la precaución de no romper la interface agua-sacarosa.
- El contenido de los tubos se vertió en un tamiz de 45 μm y se lavó con agua destilada para eliminar la sacarosa.
- El contenido del tamiz se recogió en envases de vidrio y posteriormente se agregó en una capsula de Doncaster especial, para hacer el conteo de esporas.
- La identificación de los HMA a nivel de género se efectuó con la ayuda de claves taxonómicas (Brundrett et al. 1996, Peterson et al. 2004, Powell y Bagyaraj 2000, INVAM 2009). Para evaluar el número de esporas de HMA por gramo de suelo húmedo (gsh-1) se realizó un análisis descriptivo.
Tinción de raíces para evaluar el porcentaje de colonización
El porcentaje de colonización de los HMA en los sistemas radicales, se realizó mediante el procedimiento de decoloración y tinción (Phillips y Hayman, 1970)
- Se lavaron las raíces con abundante agua corriente.
- Se les agrego una solución de Hidróxido de potasio (KOH) al 10% y se llevaron al baño de María (90°C) durante 15 minutos.
- Se eliminó el hidróxido de potasio, lavando con agua corriente las raíces, utilizando preferiblemente un tamiz adecuado para evitar pérdidas durante el enjuague.
- Acidificar con una solución de ácido clorhídrico (HCl) al 1N durante 10 minutos.
- Decantar el HCl y sin lavar adicionar Azul de Tripano al 0.05 % en lactoglicerol o cualquier otro colorante y colocar las raíces al baño de María por 15 minutos.
- Retirar el colorante y guardarlo en un recipiente que contiene lactoglicerol (50 %).
- Montar en lámina y laminilla, 10 raíces de más o menos 1 cm de largo cada una y observar al microscopio.
- Se evaluó de cada tratamiento por triplicado, una muestra de 10 segmentos de raíces de aproximadamente 2 cm de longitud, los cuales se colocaron paralelamente en un portaobjeto de manera perpendicular al eje más largo, se les añadió lactoglicerina a las raíces y se les colocó otro portaobjetos encima a fin de protegerles completamente.
- La frecuencia de colonización radicular se determinó considerando los segmentos colonizados y los no colonizados. Se obtuvo la relación del total de segmentos colonizados con respecto a los segmentos totales evaluados. Se contabilizó con base a colonización total por arbúsculos o/y por vesículas.
Para la evaluación fitosanitaria del follaje y raíces se colocaron tres muestras del material en placas de Petri con papel absorbente, estas se dejaron a temperatura ambiente por tres días, el cual es el tiempo necesario para el crecimiento de los hongos. La identificación de los hongos se realizó a través la clave de hongos por Monte .B. Roberto (1992), y la presencia de insectos fitopatógenos el follaje se evaluó bajo la lupa estereoscópica y se identificaron los insectos presentes en el material utilizando la clave para su identificación de (White. E R 1983)
En cuanto a la determinación del PH, se realizó por el método de Jackson (1976).
Resultados y Discusión
Los análisis de las muestras procesadas en el laboratorio de Química Biológica del UPTMA, arrojaron la siguiente información.
Tabla 1
Análisis de las muestras de los suelos
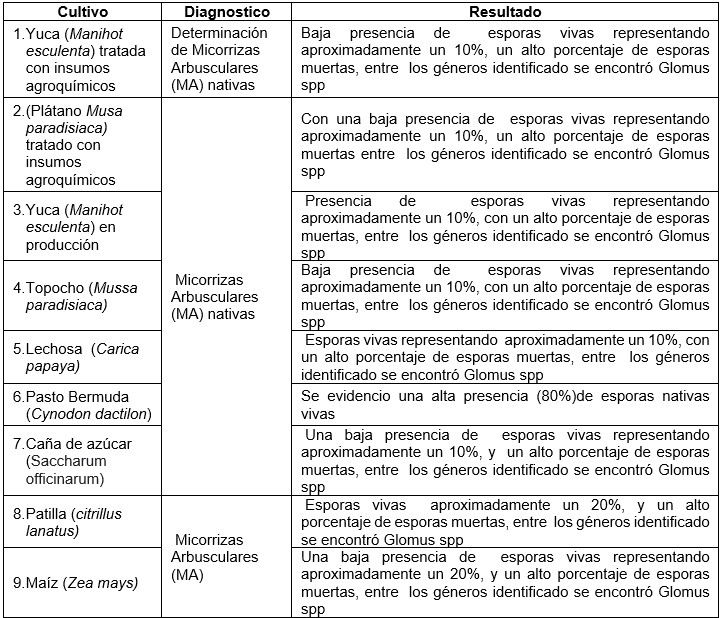
Fuente: Chacón A., González M (2024).
La tabla 1 la mayoría de los cultivos presentaron baja presencia de estructuras de reproducción representadas vivas por esporas (10% a un 20%) de micorrizas arbusculares nativas y un alto porcentaje de esporas muertas, del género identificados, Glomus spp. Solo se observó diferencias en cuanto a la población de esporas vivas (con un 80%) Pasto Bermuda (Cynodon dactilon) de los géneros identificados, se encuentra el género Glomus spp.
Tabla 2
Análisis de las muestras de las raicillas
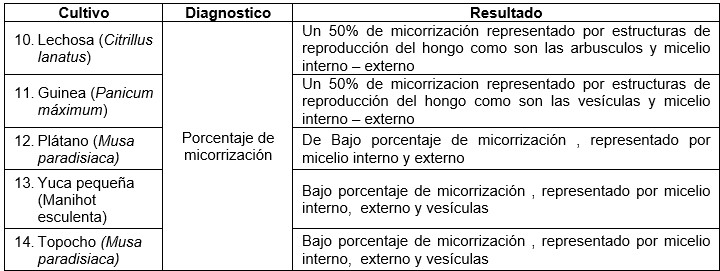
Fuente: Chacón A., González M (2024).
En la tabla 2 se muestra el análisis de la Raicillas de cada uno de los cultivos analizados se encuentra lo siguiente: los rubros Lechosa (Citrillus lanatus) y Guinea (Panicum máximum) presentaron un 50% de micorrizacion representados por la presencia de micelio externo e interno, a diferencia del Plátano (Musa paradisiaca), Yuca (Manihot esculenta y Topocho (Musa paradisiaca), en producción, se observaron un bajo porcentaje (20%) de micorizacion representado por micelio interno, externo y vesículas.
Tabla 3
Análisis de las muestras para el Follaje

Fuente: Chacón A., González M (2024).
Con respecto a la tabla 3, muestra el estudio del análisis fitosanitario en el follaje, de los rubros plátano y lechosa debido a que los síntomas observados eran característicos del ataque hongos fitopatogenos y ácaros, En la Lechosa (Carica papaya), se observó una alta presencia de ácaros, vectores de virus, presencia de conidias de fusarium spp. En el follaje del Plátano (Musa paradisiaca) no se observaron estructuras de hongos fitopatógenos. Mientras que en los otros como Yuca, Maíz, Caña de Azúcar, Patilla, Pasto Bermuda, Guinea no se observaron síntomas de ataques a nivel de campo.
Tabla 4
Análisis de las muestras para el Follaje

Fuente: Chacón A., González M (2024).
La tabla 4 representa la medición del Ph en el suelo se evaluó el Ph donde estaban los cultivos de musáceas, lechosa, yuca y gramíneas debido al manejo agronómico que se aplica a esos cultivos, basados en agroquímicos.
Los resultados obtenidos van de suelos ligeramente ácidos en los cultivos de musáceas, yuca, gramíneas, mientras que en el cultivo de lechosa se observa un Ph ligeramente alcalino.
Los suelos estudiados evidencian presencia de hongos formadores de micorrizas nativas que van desde muy bajas hasta un alto porcentaje de micorrizacion dependiendo del cultivo en estudio, tal es el caso de la yuca, el plátano, la caña de azúcar, la lechosa, la patilla. Se infiere que este bajo porcentaje se debe al uso continuo de agroquímicos para el control de plagas y enfermedades y para la nutrición del suelo, reduce la actividad biológica de los microorganicos benéficos entre ellos los MA.
En las raicillas evaluadas de los cultivos se observó presencia de estructuras de reproducción correspondientes a las MA. Solo en el follaje de la lechosa se observaron ácaros y Fusarium sp. Aunque es una sola unidad de producción se evidenciaron sectores con Ph diferentes, que van desde ligeramente ácidos y ligeramente alcalinos.
Conclusiones
Los suelos estudiados evidencian presencia de hongos formadores de micorrizas nativas que van desde muy bajas hasta un alto porcentaje de micorrizacion dependiendo del cultivo en estudio, tal es el caso de la yuca, el plátano, la caña de azúcar, la lechosa, la patilla. Se infiere que este bajo porcentaje se debe a las prácticas de manejo de los cultivos tales como el uso continuo de agroquímicos para el control de plagas y enfermedades y para la nutrición del suelo, los procesos de preparación del suelo que es realizado por varios pasos de rastra esto reduce la actividad biológica de los microorganicos benéficos entre ellos los MA.
En las raicillas evaluadas de los cultivos se observó presencia de estructuras de reproducción correspondientes a las MA.
Solo en el follaje de la lechosa se observaron ácaros y Fusarium sp.
Aunque es una sola unidad de producción se evidenciaron sectores con Ph diferentes, que van desde ligeramente ácidos y alcalinos, este parámetro es indicativo que en una unidad de producción se encuentran diferentes tipos de suelo y el manejo de los mismos se debe de realizar tomando en consideración sus caracterizas químicas, biológicas y físicas.
Referencias consultadas
Altieri MA (1994) Biodiversity and pest management in agroecosystems. Hayworth Press, New York. 185 pg.
Brundrett, M; Bouguer, N; Dell, B; Malajczuck, N. (1996). Working with mycorrhizae in forestry and agriculture. Canberra, AU. ACIAR Monograph 32.374. Pirie Printers. 369 p.
Jackson M. 1976. Análisis químico de suelos. Barcelona: Omega. 662p
Jeffries, P. Y Barea, J. (1999). Arbuscular Mycorrhiza a key component of sustainable plant – soil ecosystems. The mycota IX, fungal associations. Edition Hock.
Gerderman, J; Nicholson, T.(1963). Spores of mycorrhizal endogene species extracted from soil by wet sieving and decanting. Transactions of the British Mycological Society 46:235-244.
INVAM (2009). (International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi). sf. Arbuscular mycorrhizal fungi. Key to fungi in glomales. (En línea). Consultado 30 jul. Disponible en http:// invam.caf.wvu.edu/index.html
León, V. D (2006). Evaluación y caracterización de micorrizas arbusculares asociadas a yuca (Manihot esculenta sp) en dos regiones de la amazonia de Colombia, tesis de pregrado para optar el título de Microbiólogo agrícola y veterinario p 125.
Montes. B Robert (1992) Identificación de hongos fitopatogenos CIIDIR OAXACA 149 p.
Phillips, J; Hayman, D. (1970) Improved procedures for clearing roots and staining parasitic and vasicular–arbuscular mycorrhizal fungi for rapid assessment of infection”. Transactions of the British Mycological Society 55:158-161.
Powell, C; Bagyaraj, D. (2000). MA Mycorrhiza. Florida. Printed in the United States. 32 p.
Rodríguez et al., (2011). Efecto de prácticas agronómicas sobre la conservación de los suelos degradados bajo riego. En la zona central del Valle del Río Portoviejo la Técnica marzo 2011 p 7.
Urdaneta, R. (2011). El suelo. En línea: http://www.monografias.com/trabajos15/suelo-erosion/suelo-erosion.shtml#EROSION#ixzz3I6v3p7V2. Consultado: 4 Noviembre, 2014.
White R. A field guide to the Beetles. Library of Congress Cataloging in Publication Data. 1983.Printed in United States of America p 343.
©2024 por el autor. Este artículo es de acceso abierto y distribuido según los términos y condiciones de:
| ISSN: 2443-4426 |  Esta obra está bajo una Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial 4.0 Internacional. |
